
1. Western blot의 개요
오늘은 생화학 실험 기법 중 하나인 western blotting에 대해서 알아보겠습니다. Blotting은 특정 샘플을 겔을 통해 분리하고, 막으로 옮겨 막표면에서 검출하는 실험법을 의미합니다. 어떤 샘플이냐에 따라서 다른 별칭으로 불리고 있습니다.
- DNA sample을 이용하는 실험: southern blot
- RNA sample을 이용하는 실험: northern blot
- Protein sample을 이용하는 실험: western blot
western blot은 항체를 이용하는 방법상의 특징으로 인해 immunoblotting이라는 명칭으로도 불립니다. 웨스턴 블랏을 통해서 세포 혹은 조직에서 발현되어 있는 타겟 단백질을 반정량적으로 확인할 수 있어, 분자생물학에서 자주 사용되는 연구 기술입니다.
지금부터 western blot에서 사용되는 시약이나 방식을 이유와 원리와 함께 알아보면서 소개해드리겠습니다.
2. Western blot의 절차 간단 정리

전체 단계를 크게 4가지로 나누어 보자면 다음과 같습니다.
- 단백질 샘플을 전기영동법 적용한 폴리아크릴아미드겔에서 분리
- 니트로셀룰로오스 막으로 전달
- 1차 항체 및 효소를 tagging한 2차 항체를 붙여 반응
- 기질 반응을 통한 검출
세부 사항에 대해서는 아래에서 차례대로 설명드리겠습니다.
3. Western blot의 절차 (1): 단백질 분리 및 전기영동 준비
1) 샘플 및 단백질 용해 완충제 준비
채취한 샘플을 단백질 분해를 방지하기 위해 얼음 위에 두고, RIPA buffer와 같은 단백질 용해완충제(protein lysis buffer)와 반응시켜 줍니다. 특히 막단백질과 같이 분리하기 어려운 단백질을 목표로 실험을 하는 경우, 용해하기 위한 적절한 detergent를 사용해야 합니다.

Detergent는 세포막을 분해시키고 단백질의 구조 및 결합을 끊어 주는 역할을 하기 때문에, 사용하는 종류에 따라서 용해되는 단백질과 용해 정도가 차이가 납니다.
반드시 사용하는 단백질 용해완충제는 용도에 따라서 선택해줍니다. 단백질 용해완충제에는 단백분해효소 억제제(protease inhibitor)를 넣어, 최대한 단백질 분해를 방지해 줍니다.
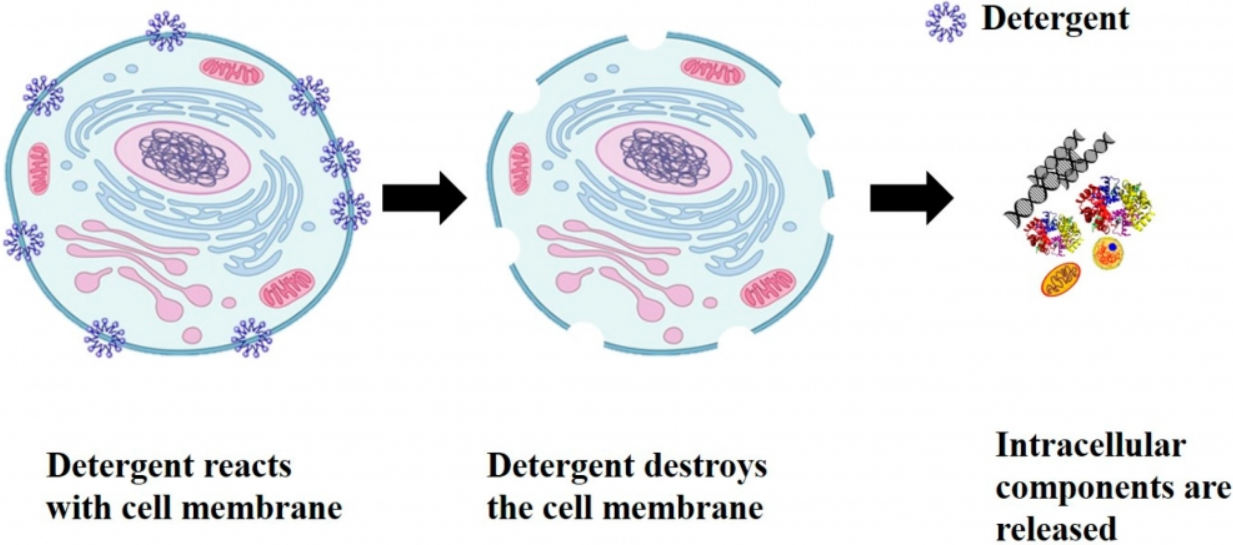
2) 단백질 용해
얼음 위에서 최대한 신속하게 scrapper 혹은 pippet을 이용하여 용해완충제에 세포를 분산시켜, 표면적을 최대로 하여 용해가 잘 될 수 있게 만들어 줍니다.
일정 시간 반응 후 (~30 min), 원심분리 (~15,000 rpm)를 통해 세포 잔해물은 가라앉히고, 단백질이 포함된 상층액을 얻습니다.
3) 단백질 정량 및 전기영동 샘플 준비
단백질과 반응하여 일정 흡광도를 나타내는 Bradford 혹은 BCA를 이용한 assay를 통해, 추출해낸 단백질량을 계산하는 정량 과정을 거칩니다.
원하는 량의 단백질이 들어간 buffer를 분리해낸 후, 전기영동하기 위한 작업이 필요합니다. 샘플 버퍼(로딩 버퍼)와 반응시켜 단백질의 환원/구조변형을 일으킵니다. 샘플 버퍼에 들어가는 성분과 작용은 다음과 같습니다.
- 2-mercaptoethanol : 단백질의 3차 구조를 이루는 cystein의 disufide 결합을 끊어주어, 단백질의 구조에 의한 분리 현상을 방지합니다. 유지시켜 주는 역할을 하는 DTT와는 반대 되는 역할입니다.
- SDS: 3차 구조의 변형을 보조하고, 단백질 분자량에 따른 음전하를 부여함으로써, 전기영동에 의한 이동을 가능하게 합니다.
- Glycerol: 단백질 샘플과 섞여서 적당한 무게를 부여하여, SDS-PAGE의 well에 잘 정착되게끔 합니다.
- Bromophenol: 단백질 샘플과 섞여서 푸른색으로 눈에 잘 보일 수 있게 합니다.
샘플 버퍼와 잘 섞어준 후, 5분간 99도에서 반응시켜 단백질 구조를 변형시켜 줍니다. 여기까지 진행했으면, 준비한 샘플을 전기영동법을 이용해서 단백질 분리를 진행합니다.
4. Western blot의 절차 (2): 전기영동법 (electrophoresis)
1) 폴리아크릴아미드 겔 샘플 로딩
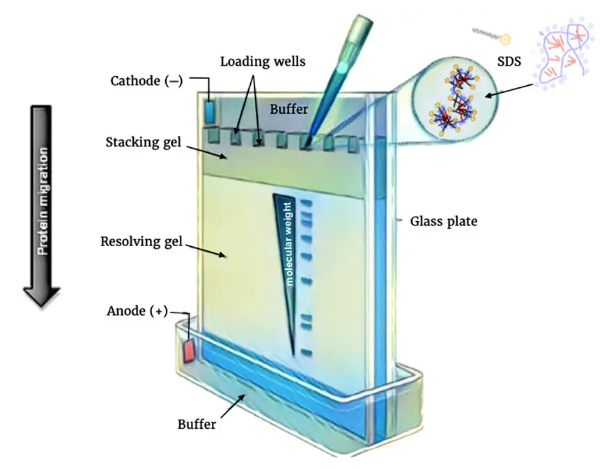
전기영동 샘플을 준비하는 단계에서, 다음과 같은 조건을 만들게 됩니다.
- SDS를 이용해서 단백질에 음전하를 부여하여, 전극 사이에 흐르는 전류를 따라 음전하를 띤 단백질이 이동할 수 있음
- 2-mercaptoethanol 등을 이용해 단백질 3차 구조를 분해시킴으로써, 폴리아크릴아미드의 그물 구조를 이용하여 단백질 크기에 따라 분리할 수 있음
(아크릴아미드의 비율에 따라서 분리 정도의 차이를 줄 수 있습니다. 아크릴아마이드의 비율이 높을수록, 그물 구조의 기공 크기는 작아집니다. 따라서 비율이 높으면 저분자량 단백질을, 비율이 낮으면 고분자량 단백질 더 자세하게 분리할 수 있습니다.)
미리 준비한 단백질 샘플을 폴리아크릴아미드 겔에 로딩하여 전기영동을 실행함으로써 단백질을 크기별로 분리할 수 있게됩니다.
전기영동장치에 겔을 조립하고, 겔에 전류가 흐를 수 있도록 하는 running buffer로 겔 사이 공간과 전기 영동 챔버를 채워줍니다.
- Running buffer 조성: 25 mM Tris base, 190 mM glycine, 0.1% SDS
- Glycine은 Cl- 이온과 함께, stacking gel 로딩된 단백질을 압축해 주는 역할을 하며, SDS를 통해 음전하를 부여하는 역할을 합니다.
샘플을 폴리아크릴아마이드 웰에 로딩하고, 추가로 분자량을 크기별로 분리할 수 있게 도와주는 가이드 시약(ladder)을 넣어줍니다.
전기영동 중에 단백질 분리를 모니터링하고, 이후 검출 및 분석 시 원하는 단백질인지 분자량을 통해 확인할 수 있게 도와줍니다.
2) 전기영동 진행

전기영동 장치에 전원 공급 장치에 연결하고 작동시킵니다. 일반적으로 80~200V에서 60~90분 동안 작동시키며, 보통 로딩 버퍼가 겔을 빠져나갈 때까지 혹은 원하는 단백질이 충분히 분리되어 확인할 수 있는 정도까지 작동시킵니다.
단백질은 acrylamide가 polymer를 이루면서 생기는 구조를 빠져나가면서, 높은 분자량을 가지는 단백질은 상대적으로 천천히 내려오고, 낮은 분자량을 가지는 단백질은 상대적으로 빠르게 내려오는 원리를 이용하여 분리됩니다.
속도가 분자량에 의해 부여되는 전하량에만 비례하도록, 3차 구조를 2-mercaptoethanol을 이용해 분해해줄 필요가 있는 것 입니다.
ladder를 통해 확인해 가며, 원하는 정도까지 전기영동을 실행해 줍니다.
3) Transfer 과정
전기영동을 통해 분리시킨 단백질에 항체를 반응시키기 위해, 단백질을 겔에서 멤브레인으로 옮겨 주는 과정입니다. 하전 된 단백질을 전류 흐름을 이용하여 옮긴다는 원리 자체는 전기영동법과 같습니다.
과정은 습식 과정(wet transfer) 및 건식 과정(semi-dry transfer)으로 나누어집니다. 최근에는 간단하고 빠르게 진행할 수 있는 건식 과정이 많이 사용되고 있지만, 확인하고자 하는 단백질이 분자량이 커서 오랜 시간 transfer를 할 때는, 열 발생을 최소화할 수 있는 습식 과정이 더 안정적이기 때문에, 습식 과정이 사용되기도 합니다.
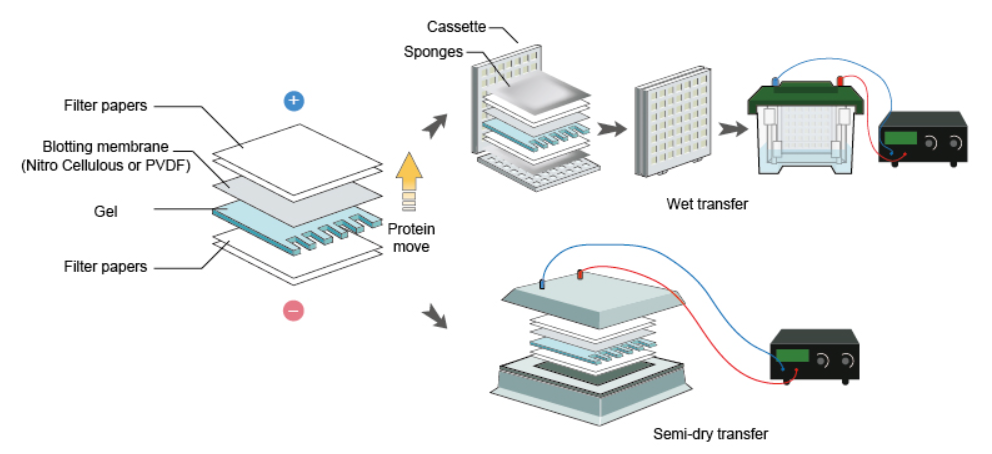
이 과정에서 사용하는 멤브레인과 transfer buffer는 다음 용도로 사용됩니다.
- Membrane
- Nitrocellulose (NC): 가격이 비교적 저렴하고, non-specific binding이 상대적으로 적습니다. 하지만 내구도가 약하고, 단백질이 붙은 정도가 약해 잘 정착되지 않을 수 있고 re-probing 과정에서 단백질이 탈락될 수 있습니다.
- Polyvinyldenefluoride (PVDF): 내구도가 강하고 단백질이 강하게 결합하여 re-probing 과정에서 안정적입니다. 하지만 가격이 비교적 비싸고, methanol을 통한 활성화 작업이 필요합니다. - Transfer buffer: 전기영동과 유사한 원리로 SDS를 통해 부여된 전하를 이용하여, 단백질이 겔에서 멤브레인으로 이동하도록 하고, buffer에 포함되는 methanol은 단백질-멤브레인의 결합을 강하게 만들어 잘 정착되도록 돕습니다.
Transfer 과정은 보통 다음 순서로 진행됩니다.
- 카세트에서 젤을 분리, 겔에서 필요 없는 부분 (상단 및 하단부)를 절단
(폴리아크릴아미드 비율이 낮을수록 겔이 부드러워서 찢어지거나 손상될 가능성이 높으니 주의합니다.) - Transfer 카세트 위에 transfer buffer를 적신 스펀지를 올린 뒤, 기포를 최대한 제거하고 멤브레인을 올립니다.
(겹겹이 올리는 과정에서 사이에 기포가 들어가지 않도록 주의하고, 구성품들이 마르지 않도록 신경 써 줍니다.) - 멤브레인 위에 겔을 올리고 다시 스펀지를 올려서 샌드위치를 만들어 줍니다.
- 롤러를 이용해서 샌드위치 사이의 기포를 잘 제거해 줍니다. 최대한 조심스럽게 진행해서, 겔이 찌그러지거나 밀리지 않도록 합니다.
- 카세트 리드를 조심히 올려서 결합한 다음, 기계를 작동시킵니다. 이때 전극 방향이 올바르게 설정됐는지 확인합니다.
(그렇지 않으면 거꾸로 전류가 흘러서, 완전히 실패하게 될 수 있습니다.) - 작동 시간은 여러 회사 제품에 따라 차이가 있으니, 해당 회사에서 제공하는 매뉴얼에 따라서 진행하시길 바랍니다.
(보통 분자량이 높을수록, 높은 전압/전류/작동시간이 필요합니다.)
습식 과정도 원리 자체는 동일하고, 실험 과정의 일부분만 다르니 참고하셔서 진행할 수 있습니다.
5. Western blot의 절차 (3): 항체 반응 및 검출
1) Blocking 단계

Transfer 과정 이후, target으로 단백질에 특이적으로 결합하는 항체를 반응시켜 주기 이전에, Ponceau S, Coomassie blue staining을 통해 겔에 있는 단백질이 멤브레인으로 문제 없이 이동했는지 확인하는 과정을 선택적으로 진행 할 수 있습니다. (기포로 인한 부분적인 누락 등을 확인)
- Ponceau S가 물에 녹으면 Na+가 떨어져 나가 O- 부분이 노출되어, 단백질에 결합하게 되어 염색됩니다. 멤브레인 위로 이동한 모든 단백질이 염색되므로, 누락된 부분을 확인 할 수 있습니다.
- 확인 후에는, TBS 등으로 세척하면 쉽게 제거되어 다음 단계로 진행 할 수 있습니다.
항체가 멤브레인에 존재하는 타겟 단백질 외에 결합하는 것을 막기 위해, blocking buffer를 이용하여 멤브레인의 단백질이 존재하지 않은 영역을 코팅해줍니다.
- 5% skim milk 혹은 bovine serum alvumin (BSA)을 이용합니다.
- 이런 단백질을 이용하여, 멤브레인에 단백질이 옮겨지지 않은 부분을 masking하여, 항체가 멤브레인 빈 부분에 비특이적인 결합을 하지 않도록 합니다. 이를 통해 background를 줄여 더 깨끗한 데이터를 얻을 수 있습니다.
2) Antibody binding 단계
Blocking에 사용된 동일한 buffer에 1차 항체를 추가해 주어, 1차 항체에 반응시키는데 사용합니다. 항체 제품마다 western blot 또는 이용하는 실험에 추천하는 비율(1:100~1:1000)을 소개하고 있으니 참고합니다.
- 1차 항체는 원하는 단백질에 특이적으로 결합하는 항체입니다.
- 항체는 특정 단백질 뿐만아니라, 단백질의 origin(human, mouse rat 등 유래한 종)에 따라서 특이적으로 반응합니다. 항체 구매시에, 반드시 이 부분을 확인하시기 바랍니다.
멤브레인을 1차 항체 반응 buffer에 넣어준 후, 4℃ 환경의 rocker에서 overnight 반응시켜줍니다. (상온에서 반응하면 빠르게 결합 시킬수 있으나, 항체를 재사용 할 수 없는 단점이 있음)
다음날 1차 항체를 제거합니다(수거하여 -20 ℃에 보관하면, 이후 재사용할 수 있습니다). TBS-T(Tween를 포함하는 TBS)를 이용하여 멤브레인에 붙어 있지 않은 1차 항체를 세척합니다. (보통 10분간 3회 내외)
상온 환경의 rocker에서 적절한 시간(1~2시간) 동안 2차 항체 반응 buffer(blocking buffer + 2차 항체, 비율은 보통 1:1000)에서 반응시켜 줍니다.
- 2차 항체는, 1차 항체에 특이적으로 결합하는 HRP-tagged antibody입니다.
- 2차 항체는 1차 항체의 origin에 따라서 특이적으로 결합합니다. 1차 항체를 추출해 낸 동물(mouse, rabbit 등)에 따라서 달라지니, 이를 확인하여 선택하시길 바랍니다.
- 2차 항체는 상온 반응으로 인한 HRP 활성 저하를 이유로 재활용하지 않습니다.
- 참고로, 1차/2차가 동시에 결합된 상품도 있으나, 경제적인 이유로 잘 사용하진 않습니다. 이러한 제품을 선택하시면 좀 더 수월하게 실험을 진행할 수 있습니다.
반응 후 TBS-T를 이용하여, 반응하지 않은 2차 항체를 세척하시면, 검출 단계를 진행할 수 있습니다.
3) Detection 단계

멤브레인을 ECL(Enhanced chemiluminescence) 용액과 잘 반응시키기 위해, 묻어 있는 용액을 최대한 제외한 후 ECL 용액에 넣어 반응시킵니다.
- ECL 용액은 두가지 용액으로 구성되어 섞어서 사용하는데, 각각 luminol과 hydrogen peroxide를 포함하는 용액입니다.
- 두가지 용액을 섞어서 멤브레인에 반응시키게 되면, 2차 항체에 붙어 있는 HRP(horseradish peroxidase)와 반응하여 hydrogen peroxide를 분해시키고, 여기서 나오는 OH-가 luminol을 산화시키며 발광하게 됩니다.
- 발광하는 정도를 측정하는 기계인 chemiluminescence detector를 이용하여 이미지를 얻게 됩니다.
이후 측정한 멤브레인을 stripping buffer를 이용하여 항체를 제거한 다음, 다른 1차 항체를 이용하여 다른 단백질을 검출할 수 있습니다.
- Stripping buffer는 낮은 pH 혹은 SDS 및 mercaptoethanol를 이용하여 항체 기능을 저하시키는 기능을 합니다.
6. Western blot 원리 및 실험 방법 마무리
Western blot은 생화학 실험 기법에서 많이 사용되기 때문에, 실험실 마다 실험 방법에는 차이가 있고, 이에 따라서 실험 결과가 달라지는 경우가 적지 않습니다. 세부 사항에 대해서는 직접 실험을 해보시면서 조절하고, 결과에 아쉬운 점이 있다면 bric과 같은 커뮤니티 혹은 주변 동료들에게 물어가며 trouble shooting을 통해서 결과를 최적화하는 과정이 필요하겠습니다.
https://www.ibric.org/bric/index.do
BRIC
SCODA를 이용한 단일세포 RNA-seq 데이터 마이닝 실습 (조직/종양 미세환경 들여다보기) 2024.03.22 ~ 03.22 (주) 엠엘비아이랩 워크샵 2024년 세계 오가노이드 날 제정 기념 춘계학술대회 2024.04.03 ~ 04.03 오
www.ibric.org
궁금하신 점이 있다면 댓글로 남겨주시면, 아는 범위 내에서 답글을 달아보도록 하겠습니다. 이상으로 실험 방법에 대한 소개를 마치겠습니다. 감사합니다.
'생화학' 카테고리의 다른 글
| [생화학] PCR의 원리 및 실험 방법 (principle & protocol) (0) | 2024.03.26 |
|---|
